Blödning efter PCI är för AKS-patienter lika farligt som en re-infarkt.
Blödning (major bleeding) efter angio/PCI för AKS är associerat med ökad mortalitet. 1 Major bleeding påverkar prognosen på samma nivå som ischemiska komplikationer efter angio/PCI för AKS, 2 3 se mer detaljerat nedan. Enkelt uttryckt: En större blödning efter PCI är hos en AKS-patient lika farligt som en re-infarkt. Det är därför alltid viktigt att göra en avvägning om ischemirisken eller blödningsrisken är farligast för den individuella patienten. Det som skulle behövas är ett verktyg (ett score) som exakt predikterar blödningsrisken och ischemirisken för den individuella patienten, tyvärr finns detta exakta verktyg inte än, och även om flera scores för att skatta blödningsrisken har utvecklats har inget testats prospektivt i en RCT.
Sidoinnehåll
Blödning: Definitioner
Flera verktyg för att mäta och definiera blödning har utvecklats för kliniska studier. Den senast och aktuellt mest använda är BARC (Bleeding Academic Research Consortium) definition for bleeding. 4 Syftet med dessa definitioner är främst att kunna mäta blödning som outcome parameter i kliniska studier. Notera att BARC bleeding (och andra blödningsdefinitioner) mäter blödning som redan har skett, det är inte en risk score (alltså inte för att prediktera blödning).
BARC definitionen indelar blödning efter siffror (BARC 1-5). Ett flertal definitioner som tidigare har använts i kliniska studier har definierat blödning efter “minor” och “major” (TIMI, CURE, ACUITY, PLATO) eller “severe” (CURRENT-OASIS). En bra översikt över skillnad mellan olika definitioner finns i BARC-publikationen.
Hur stort är blödningsrisken för min patient?
Stycket ovan definierar blödning som redan har skett. Detta avsnitt handlar om att prediktera blödning i framtiden, det vill säga om bedömning av risken.
Det finns olika verktyg för att skatta blödningsrisken för en individuell patient. Det är vanligtvis ingen rutinåtgärd att använda blödningsriskscores men kan vara lämpligt på utvalda patienter. Det finns olika scores som är validerade för olika patientgrupper.
Blödningrisk hos patienter efter PCI (AKS och stabil angina):
ARC-HBR definition för hög blödningrisk används för patienter som genomgår PCI, AKS och CCS. Den publicerades 2019 och rekommenderas i ESC NSTE-ACS guideline 2020. Tidpunkt för användning är vid PCI.
PRECISE-DAPT-Score predikterar blödning hos patienter som behandlas med DAPT efter PCI. Tidpunkt för användning är det initiala vårdtillfället.
Blödningsrisk vid AKS (koronarangiograferade patienter)
För AKS-patienter finns det två blödnings-scores: ACUITY och CRUSADE. ESC ESC NSTE-ACS guideline 2020 föredrar CRUSADE score (över ACUITY) för att vara diskriminatoriskt bättre men ger endast en IIB (“may be considered”) rekommendation. CRUSADE predikterar in-hospital major bleeding.
Blödningsrisk i samband med oral antikoagulation vid förmaksflimmer:
För denna patientgruppen används HAS-BLED score.
Handläggning av blödning
En bra översikt över terapistrategier vid blödningschock hittar du i ett open-scoure arbete i British Journal of Anaesthesia , t ex “deliberate hypotension”, att acceptera lägre blodtryck för att förbättra hemostas. 5 6
Blödning vid antitrombocytär behandling
Än så länge finns det ingen antidot mot trombocythämmare (men det är under utveckling för Ticagrelor, för detaljer se Ticagrelorsidan).
Trombocyt-transfusioner används regelbundet vid blödning hos antitrombocytärt behandlade patienter, även om det inte finns mycket evidens för effekten. 6 Trombocyt-transsfusionen hade i ett arbete från Sahlgrenska god effekt hos ASA-behandlade patienter men sämre vid ADP-hämmare behandling 7. Viktig att påpeka är att trombocyt-transfusionens effekt beror på tiden från sista dos av ADP-hämmare: Trombocyt-transfusionen ger god effekt om den ges > 6 timmar efter sista dos Clopidogrel eller Prasugrel, 8 medan det kan ta upp till 24 timmar efter sista Ticagrelor-dos. 6
Blödning vid NOAK behandling
Handläggning av blödning hos NOAK-behandlade patienter beskrivs i en ACC konsensus-report från 2017. 9
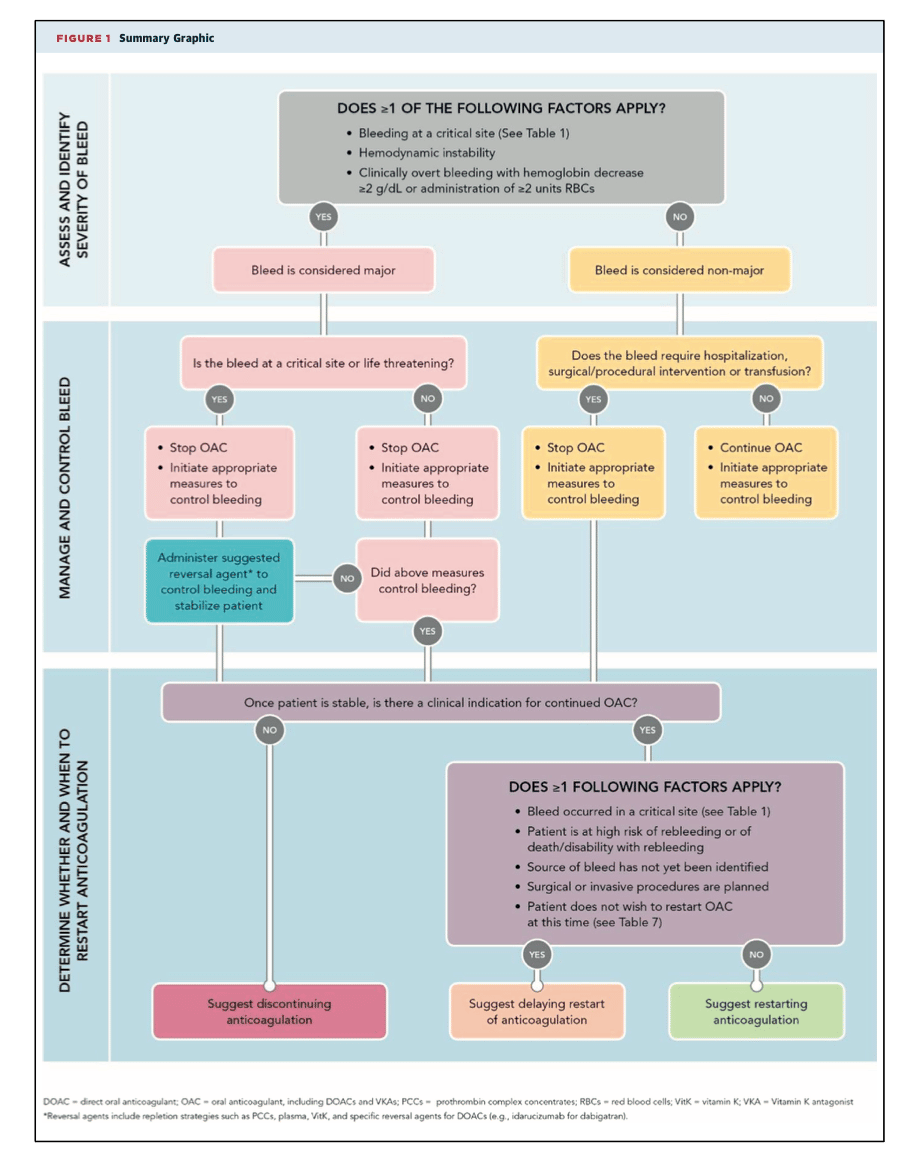
ACC 2017: Flowchart handläggning blödning under NOAK: (klicka på dropdown)Förbättring av hemostas förväntas 12-24 h efter utsättning av NOAK. 6
Vid allvarlig eller livshotande blödning:
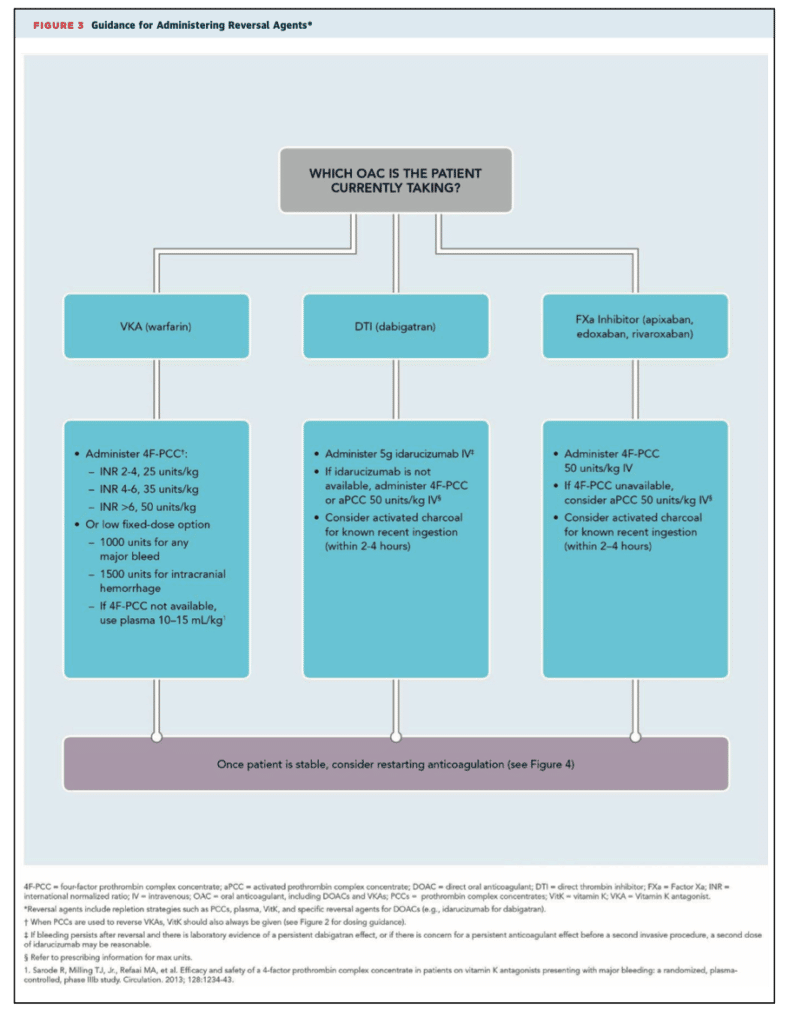
Idag används antidot mot den orala trombinantagonisten 10 Dabigatran (Pradaxa®): Antidot är Idarucizumab (Praxbind®), en monoklonal antikropp som var effektiv (dosering 5 g i.v.) i en studie med 500 patienter (NEJM 2017). 11 Användning av Idarucizumab vid livshotande blödning har en ESC klass IIa indikation 12
Det finns även en antidot mot orala Faktor Xa antagonister (Apixaban (Eliquis®), Edoxaban (Lixiana®), Rivaroxaban (Xarelto®)): Antidot är Andexanet alfa (Ondexxya®), ett FXa fragment (Xa antagonister binder då till Andexat alfa istället för till Faktor Xa) (se även genomgång på Läkemedelsverket). Andexanet alfa har testats på 350 patienter med akut blödning där FXa aktiviteten var utfallsmåttet (NEJM 2019) 13 Användning av Andexanet alfa vid rivaroxaban-, apixaban-, eller edoxaban-associerad livshotande blödning har en ESC klass IIb indikation 12 Denna antidot är inte allmänt tillgänglig i Sverige och rekommenderas inte som förstahands-behandling. 9, förstahandsbehandling är Protrombin-komplex:
Vid allvarlig eller livshotande blödning hos patienter behandlade med orala Faktor Xa antogonister (eller Dabigatran om antidoten inte är tillgänglig) rekommenderas behandling med Protrombin-komplex-koncentrat (PKK) (Confidex® eller Ocplex®), se även ACC flowchart ovan. 14 9 15.
Behandling med fresh frozen plasma (FFP) är sannolikt inte effektiv vid NOAK-effekt, 6 16 kan dock användas vid större blödningar där plasma behöver ersättas. 6
Blödning vid WARAN-behandling
Vid major bleeding eller livshotande blödning under pågående Wararanbehandling bör behandling med K vitamin (5-10 mg Konakion® långsamt (minst 20min) i.v. i minst 50ml vätska) och en “rapid reversal agent” övervägas: 6 16
Rapid reversal agents vid Vitamin-K-antagonist (Waran) behandling:
- Protrombin-komplex-koncentrat (PKK) (Confidex® eller Ocplex®)166
- Fördel jämfört med FFP: Mer effektiv, virusinaktiverad, behöver ej kors-testas.
- Fördel jämfört med Faktor VII: Mindre trombemboli-risk.
- Fresh Frozen Plasma (FFP)
- Rekombinant aktiverat Faktor VII (NovoSeven®)
PKK är förstahandsval. Faktor VII används endast när varken PKK eller FFP finns tillgänglig. Behandling med Protrombinkomplex (och inte FFP eller aktiverad Faktor VII) vid livshotande blödning under Waran-behandling har en ESC klass IIa indikation 12
Högt INR utan aktiv blödning: Fyra RCT 6 har testat K vitamin mot placebo. Ingen kunde visa en effekt på en klinisk ändpunkt såsom blödning, även om INR reverseras snabbare efter K vitamin administration. K vitamin “may be considered” vid INR >10 (lägre gräns vid aktiv blödning!). 6
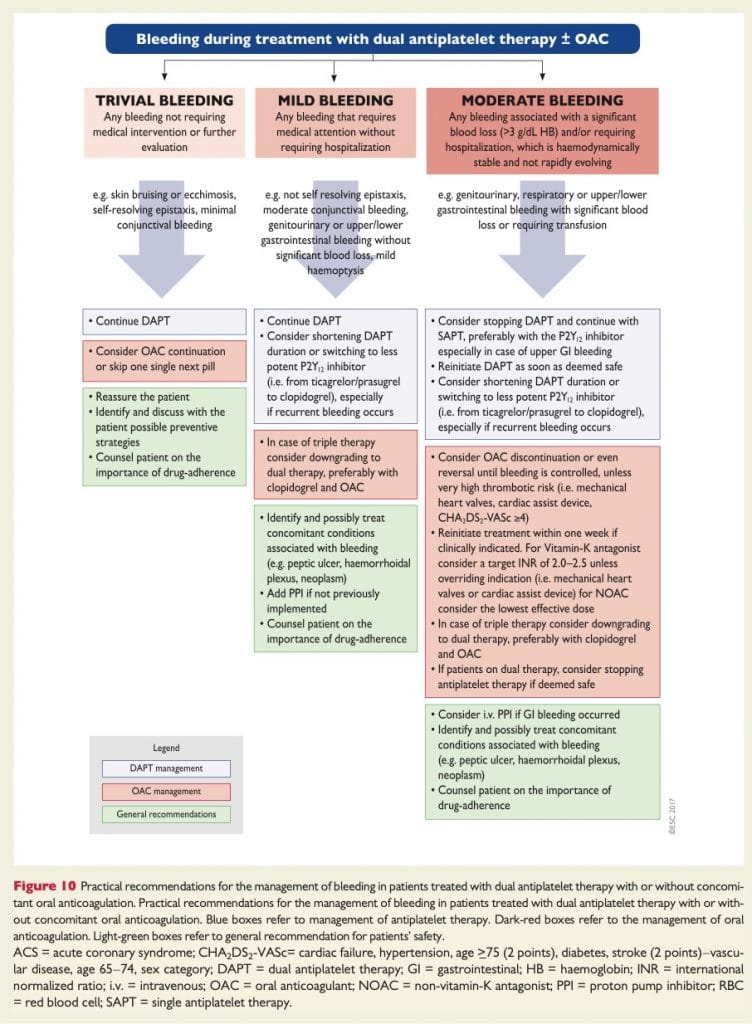
Strategi vid blödning under DAPT +/- OAC
Se ESC konsensus 2016: Management of antithrombotic therapy after bleeding in patients with coronary artery disease and/or atrial fibrillation 17
Se ESCs förslag till handläggning: 18

Transfusion
Det finns inget konsensus kring frågan när en blodtransfusion är indicerat. Kortfattat: Blodtransfusioner har olika potentiellt negativa effekter som bör vägas mot den potentiella nyttan. 19 20 21. 22 Studier som har utvärderat olika transfusionsstrategier har mest jämfört en “liberal” strategi som använder Hb <90 g/l som transfusionsgräns med en restriktiv strategi där blod ges vid Hb <70 g/L. Det finns inga större RCT i frågan, en stor meta-analys visar att en liberal transfusionsstrategi (jämfört med restriktiv strategi) hos infarktpatienter är associerat med ökad mortalitet.
CRUSADE har använt hematokrit (istället för Hb) som markör hos NSTEMI-patienter för att jämföra olika transfusions-strategier på 44000 patienter: Transfusion vid Hkt 25-30 % hade (jämfört med ingen transfusion alls) en neutral effekt på sjuhus-mortalitet, transfusion vid Hkt >30 % var associerat med ökad mortalitet, transfusion vid Hkt <25 % var associerat med en “trend” mot minskad sjukhusmortalitet. 23
Transfusion vid Hb >80 g/L eller Hkt >25 % bör alltså tänkas igenom noggrant. 6. ESC ger en klass IIb indikation för transfusion vid anemi utan tecken på aktiv blödning hos patienter med hematokrit <25 %, Hb <80 g/L (eller hemodynamisk instabilitet). 12
Betydelse av blödning efter angio/PCI
(Detta är en överblick över betydelse av blödning efter PCI – originalpublikationen (en disputation från 2019) är på engelska)
Coronary angiography/PCI is both causing bleeding and treating thrombosis:
Coronary angiography and PCI cause bleeding at the access site, from the coronary vessel (perforation), a feared complication of all PCI but most commonly occurring in CTO PCI, or in a manner that is not related to the site of access or the site of intervention (e.g., cerebral, abdominal bleeding), i.e., the bleeding is not caused by an iatrogenic, mechanic vessel damage, but related to the antithrombotic medication. This antithrombotic medication is, in part, a prerequisite to prevent the clotting otherwise induced by the catheter, balloon, or stent in all, even stable, patients and, on the other hand, is part of the treatment used for the underlying pathology, i.e., thrombosis, in patients with acute coronary syndrome.
A good portion of interventional cardiology is about preventing bleeding and preventing/treating thrombosis simultaneously. The occurrence and quantity of bleeding under or after coronary angiography and PCI is dependent on numerous factors, such as the access site, the type and dose of anticoagulants used, the indication for PCI (stable patients vs. acute coronary syndrome), acute heart failure or cardiogenic shock (CS), the operator’s expertise and PCI technique, 24 age, sex, renal function, diabetes, and peripheral vascular disease. 25 26 27 28 29 30 A fraction of bleeding events is comprised of access-site bleeding, while other bleeding events are unrelated to the access site.25 Patients who come to the cath lab with acute coronary syndrome and are strongly anticoagulated tend to experience a larger proportion of non-access-related bleeding.
Bleeding, whether it is major or minor, 31 access-site-related or non-access-site-related, 32 33 is associated with adverse outcomes, such as death, nonfatal MI, and stroke 25 28 31 34 35 36 37
Bleeding after PCI is a predictor of one-year mortality at a magnitude similar to myocardial infarction after PCI. 25 31 33 The reduction of bleeding is shown to be associated with improved survival rates 38 39 and strategies to reduce bleeding are of the greatest benefit to patients with a high bleeding risk, such as STEMI patients.33
Litteratur
ESC Guideline NSTE-ACS 2020, supplementary data
Relaterade sidor
Risker och komplikationer vid koronarangiografi och PCI
Femostop efter koronarangiografi/PCI via a. femoralis
TR-band efter koronarangiografi via a. radialis
Kärlaccess vid koronarangiografi: Femoralis eller radialis?
Last Updated on November 22, 2022 by Christian Dworeck
- Ny sida om isoprenalin - February 16, 2023
- Ny sida: ST-handledning - December 27, 2022
- Nytt EKG-exempel på sidan esofagus-EKG - November 5, 2022
- Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation [published online ahead of print, 2020 Aug 29]. Eur Heart J. 2020;ehaa575. doi:10.1093/eurheartj/ehaa575[↩]
- Ducrocq G, Schulte PJ, Budaj A, et al. Balancing the risk of spontaneous ischemic and major bleeding events in acute coronary syndromes. Am Heart J. 2017;186:91-99. doi:10.1016/j.ahj.2017.01.010[↩]
- Valgimigli M, Costa F, Lokhnygina Y, et al. Trade-off of myocardial infarction vs. bleeding types on mortality after acute coronary syndrome: lessons from the Thrombin Receptor Antagonist for Clinical Event Reduction in Acute Coronary Syndrome (TRACER) randomized trial. Eur Heart J. 2017;38(11):804-810. doi:10.1093/eurheartj/ehw525[↩]
- Mehran R, Rao SV, Bhatt DL, et al. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123(23):2736-2747. doi:10.1161/CIRCULATIONAHA.110.009449[↩]
- Dutton RP. Haemostatic resuscitation. Br J Anaesth. 2012 Dec;109 Suppl 1:i39-i46. doi: 10.1093/bja/aes389. PMID: 23242750.[↩]
- ESC Guideline NSTE-ACS 2020, supplementary data [↩][↩][↩][↩][↩][↩][↩][↩][↩][↩][↩]
- Hansson EC, Shams Hakimi C, Åström-Olsson K, Hesse C, Wallén H, Dellborg M, Albertsson P, Jeppsson A. Effects of ex vivo platelet supplementation on platelet aggregability in blood samples from patients treated with acetylsalicylic acid, clopidogrel, or ticagrelor. Br J Anaesth. 2014 Mar;112(3):570-5. doi: 10.1093/bja/aet339. Epub 2013 Oct 22. PMID: 24148324.[↩]
- Zafar MU, Santos-Gallego C, Vorchheimer DA, Viles-Gonzalez JF, Elmariah S, Giannarelli C, Sartori S, Small DS, Jakubowski JA, Fuster V, Badimon JJ. Platelet function normalization after a prasugrel loading-dose: time-dependent effect of platelet supplementation. J Thromb Haemost 2013;11:100?106.[↩]
- Tomaselli GF, Mahaffey KW, Cuker A, Dobesh PP, Doherty JU, Eikelboom JW, Florido R, Hucker W, Mehran R, Messé SR, Pollack CV Jr, Rodriguez F, Sarode R, Siegal D, Wiggins BS. 2017 ACC Expert Consensus Decision Pathway on Management of Bleeding in Patients on Oral Anticoagulants: A Report of the American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017 Dec 19;70(24):3042-3067. doi: 10.1016/j.jacc.2017.09.1085. Epub 2017 Dec 1. PMID: 29203195.[↩][↩][↩]
- Hankey GJ, Eikelboom JW. Dabigatran etexilate: a new oral thrombin inhibitor. Circulation. 2011 Apr 5;123(13):1436-50. doi: 10.1161/CIRCULATIONAHA.110.004424. PMID: 21464059.[↩]
- Pollack CV Jr, Reilly PA, van Ryn J, Eikelboom JW, Glund S, Bernstein RA, Dubiel R, Huisman MV, Hylek EM, Kam CW, Kamphuisen PW, Kreuzer J, Levy JH, Royle G, Sellke FW, Stangier J, Steiner T, Verhamme P, Wang B, Young L, Weitz JI. Idarucizumab for Dabigatran Reversal – Full Cohort Analysis. N Engl J Med. 2017 Aug 3;377(5):431-441. doi: 10.1056/NEJMoa1707278. Epub 2017 Jul 11. PMID: 28693366.[↩]
- Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation [published online ahead of print, 2020 Aug 29]. Eur Heart J. 2020;ehaa575. doi:10.1093/eurheartj/ehaa575, page 34[↩][↩][↩][↩]
- Connolly SJ, Crowther M, Eikelboom JW, Gibson CM, Curnutte JT, Lawrence JH, Yue P, Bronson MD, Lu G, Conley PB, Verhamme P, Schmidt J, Middeldorp S, Cohen AT, Beyer-Westendorf J, Albaladejo P, Lopez-Sendon J, Demchuk AM, Pallin DJ, Concha M, Goodman S, Leeds J, Souza S, Siegal DM, Zotova E, Meeks B, Ahmad S, Nakamya J, Milling TJ Jr; ANNEXA-4 Investigators. Full Study Report of Andexanet Alfa for Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2019 Apr 4;380(14):1326-1335. doi: 10.1056/NEJMoa1814051. Epub 2019 Feb 7. PMID: 30730782; PMCID: PMC6699827.[↩]
- ESC Guideline NSTE-ACS2020, supplementary data [↩]
- Connolly SJ, Milling TJ Jr, Eikelboom JW, Gibson CM, Curnutte JT, Gold A, Bronson MD, Lu G, Conley PB, Verhamme P, Schmidt J, Middeldorp S, Cohen AT, Beyer-Westendorf J, Albaladejo P, Lopez-Sendon J, Goodman S, Leeds J, Wiens BL, Siegal DM, Zotova E, Meeks B, Nakamya J, Lim WT, Crowther M; ANNEXA-4 Investigators. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2016 Sep 22;375(12):1131-41. doi: 10.1056/NEJMoa1607887. Epub 2016 Aug 30. PMID: 27573206; PMCID: PMC5568772.[↩]
- Ageno W, Gallus AS, Wittkowsky A, Crowther M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e44S-e88S. doi: 10.1378/chest.11-2292. PMID: 22315269; PMCID: PMC3278051.[↩][↩][↩]
- Halvorsen S, Storey RF, Rocca B, et al. Management of antithrombotic therapy after bleeding in patients with coronary artery disease and/or atrial fibrillation: expert consensus paper of the European Society of Cardiology Working Group on Thrombosis. Eur Heart J. 2017;38(19):1455-1462. doi:10.1093/eurheartj/ehw454[↩]
- Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39(3):213–260. doi:10.1093/eurheartj/ehx419[↩]
- Kansagara D, Dyer E, Englander H, Fu R, Freeman M, Kagen D. Treatment of anemia in patients with heart disease: a systematic review. Ann Intern Med. 2013 Dec 3;159(11):746-757. doi: 10.7326/0003-4819-159-11-201312030-00007. PMID: 24297191.[↩]
- Chatterjee S, Wetterslev J, Sharma A, Lichstein E, Mukherjee D. Association of blood transfusion with increased mortality in myocardial infarction: a meta-analysis and diversity-adjusted study sequential analysis. JAMA Intern Med. 2013 Jan 28;173(2):132-9. doi: 10.1001/2013.jamainternmed.1001. PMID: 23266500.CopyDownload .nbibFormat: [↩]
- Carson JL, Carless PA, Hebert PC. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev 2012:CD002042.[↩]
- Sherwood MW, Wang Y, Curtis JP, Peterson ED, Rao SV. Patterns and outcomes of red blood cell transfusion in patients undergoing percutaneous coronary intervention. JAMA. 2014 Feb 26;311(8):836-43. doi: 10.1001/jama.2014.980. PMID: 24570247; PMCID: PMC4276400.[↩]
- Alexander KP, Chen AY, Wang TY, Rao SV, Newby LK, LaPointe NM, Ohman EM, Roe MT, Boden WE, Harrington RA, Peterson ED; CRUSADE Investigators. Transfusion practice and outcomes in non-ST-segment elevation acute coronary syndromes. Am Heart J. 2008 Jun;155(6):1047-53. doi: 10.1016/j.ahj.2008.01.009. Epub 2008 Mar 5. PMID: 18513518.[↩]
- Doyle BJ, Ting HH, Bell MR, et al. Major femoral bleeding complications after percutaneous coronary intervention: incidence, predictors, and impact on long-term survival among 17,901 patients treated at the Mayo Clinic from 1994 to 2005. JACC Cardiovasc Interv. 2008;1(2):202-209. doi:10.1016/j.jcin.2007.12.006[↩]
- Manoukian SV, Feit F, Mehran R, Voeltz MD, Ebrahimi R, Hamon M, Dangas GD, Lincoff AM, White HD, Moses JW, King SB, 3rd, Ohman EM and Stone GW. Impact of major bleeding on 30-day mortality and clinical outcomes in patients with acute coronary syndromes: an analysis from the ACUITY Trial. Journal of the American College of Cardiology. 2007;49:1362-8[↩][↩][↩][↩]
- Numasawa Y, Kohsaka S, Ueda I, Miyata H, Sawano M, Kawamura A, Noma S, Suzuki M, Nakagawa S, Momiyama Y and Fukuda K. Incidence and predictors of bleeding complications after percutaneous coronary intervention. Journal of cardiology. 2017;69:272-279[↩]
- Young K, Earl T, Selzer F, Marroquin OC, Mulukutla SR, Cohen HA, Williams DO, Jacobs A, Kelsey SF and Abbott JD. Trends in major entry site complications from percutaneous coronary intervention (from the Dynamic Registry). Am J Cardiol. 2014;113:626-30[↩]
- Mehran R, Pocock SJ, Nikolsky E, Clayton T, Dangas GD, Kirtane AJ, Parise H, Fahy M, Manoukian SV, Feit F, Ohman ME, Witzenbichler B, Guagliumi G, Lansky AJ and Stone GW. A risk score to predict bleeding in patients with acute coronary syndromes. Journal of the American College of Cardiology. 2010;55:2556-66[↩][↩]
- Mehta SK, Frutkin AD, Lindsey JB, House JA, Spertus JA, Rao SV, Ou FS, Roe MT, Peterson ED and Marso SP. Bleeding in patients undergoing percutaneous coronary intervention: the development of a clinical risk algorithm from the National Cardiovascular Data Registry. Circ Cardiovasc Interv. 2009;2:222-9[↩]
- Manoukian SV. Predictors and Impact of Bleeding Complications in Percutaneous Coronary Intervention, Acute Coronary Syndromes, and ST-Segment Elevation Myocardial Infarction. American Journal of Cardiology. 2009;104:9C-15C[↩]
- Ndrepepa G, Berger PB, Mehilli J, Seyfarth M, Neumann FJ, Schomig A and Kastrati A. Periprocedural bleeding and 1-year outcome after percutaneous coronary interventions: appropriateness of including bleeding as a component of a quadruple end point. Journal of the American College of Cardiology. 2008;51:690-7[↩][↩][↩]
- Yatskar L, Selzer F, Feit F, Cohen HA, Jacobs AK, Williams DO and Slater J. Access site hematoma requiring blood transfusion predicts mortality in patients undergoing percutaneous coronary intervention: data from the National Heart, Lung, and Blood Institute Dynamic Registry. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions. 2007;69:961-6[↩]
- Chhatriwalla AK, Amin AP, Kennedy KF, House JA, Cohen DJ, Rao SV, Messenger JC and Marso SP. Association between bleeding events and in-hospital mortality after percutaneous coronary intervention. Jama. 2013;309:1022-9[↩][↩][↩]
- Mehran R, Rao SV, Bhatt DL, Gibson CM, Caixeta A, Eikelboom J, Kaul S, Wiviott SD, Menon V, Nikolsky E, Serebruany V, Valgimigli M, Vranckx P, Taggart D, Sabik JF, Cutlip DE, Krucoff MW, Ohman EM, Steg PG and White H. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123:2736-47[↩]
- Ben-Yehuda O and Redfors B. Validation of the Bleeding Academic Research Consortium Bleeding Definition: Towards a Standardized Bleeding Score. Journal of the American College of Cardiology. 2016;67:2145-2147[↩]
- Eikelboom JW, Mehta SR, Anand SS, Xie C, Fox KA and Yusuf S. Adverse impact of bleeding on prognosis in patients with acute coronary syndromes. Circulation. 2006;114:774-82[↩]
- Lindsey JB, Marso SP, Pencina M, Stolker JM, Kennedy KF, Rihal C, Barsness G, Piana RN, Goldberg SL, Cutlip DE, Kleiman NS and Cohen DJ. Prognostic impact of periprocedural bleeding and myocardial infarction after percutaneous coronary intervention in unselected patients: results from the EVENT (evaluation of drug-eluting stents and ischemic events) registry. JACC Cardiovasc Interv. 2009;2:1074-82[↩]
- Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, Budaj A, Peters RJ, Bassand JP, Wallentin L, Joyner C and Fox KA. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. The New England journal of medicine. 2006;354:1464-76[↩]
- Mehran R, Lansky AJ, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR, Dudek D, Kornowski R, Hartmann F, Gersh BJ, Pocock SJ, Wong SC, Nikolsky E, Gambone L, Vandertie L, Parise H, Dangas GD and Stone GW. Bivalirudin in patients undergoing primary angioplasty for acute myocardial infarction (HORIZONS-AMI): 1-year results of a randomised controlled trial. Lancet (London, England). 2009;374:1149-59[↩]